常見問題
-
【知識科普】核酸提取的(de)常用方法及原理
目前常用的(de)核酸提取方法有兩種:一(yī / yì /yí)種是(shì)柱式提取,另一(yī / yì /yí)種是(shì)磁珠法提取。其中自動化提取的(de)實現主要(yào / yāo)依賴于(yú)磁珠法。
柱式提取是(shì)用于(yú)微量核酸提取的(de)較爲(wéi / wèi)簡單的(de)方法,屬于(yú)矽吸附方法的(de)一(yī / yì /yí)種,市場上(shàng)的(de)離心柱雖各有特色,但在(zài)原理上(shàng)通常可分爲(wéi / wèi)三個(gè)部分:
(1)利用裂解液促使細胞破碎,使細胞中的(de)核酸釋放出(chū)來(lái)。
(2)把釋放出(chū)的(de)核酸特異地(dì / de)吸附在(zài)特定的(de)矽載體上(shàng),這(zhè)種載體隻對核酸有較強的(de)親和(hé / huò)力和(hé / huò)吸附力,對其他(tā)生化成分如蛋白質、多糖、脂類則基本不(bù)吸附,因而(ér)在(zài)離心時(shí)被甩出(chū)柱子(zǐ)。
(3)把吸附在(zài)特異載體上(shàng)的(de)核酸用洗脫液洗脫下來(lái),分離得到(dào)純化的(de)核酸。
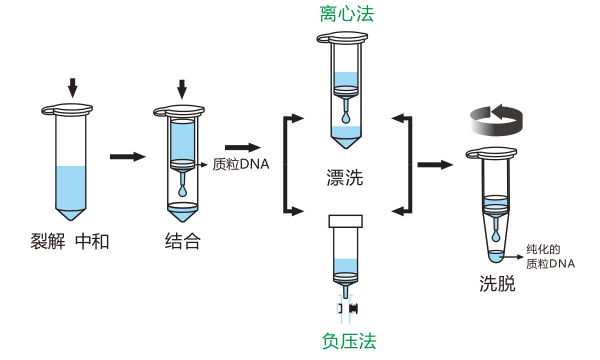
(柱式法圖解)
磁珠法提取運用納米技術對超順磁性納米顆粒的(de)表面進行改良和(hé / huò)表面修飾後,制備成超順磁性氧化矽納米磁珠。該磁珠能在(zài)微觀界面上(shàng)與核酸分子(zǐ)特異性地(dì / de)識别和(hé / huò)高效結合。利用氧化矽納米微球的(de)超順磁性,在(zài)Chaotropic鹽(鹽酸胍、異硫氰酸胍等)和(hé / huò)外加磁場的(de)作用下,能從血液、動物組織、食品、病原微生物等樣本中的(de)DNA和(hé / huò)RNA分離出(chū)來(lái),可應用在(zài)臨床疾病診斷、輸血安全、法醫學鑒定、環境微生物檢測、食品安全檢測、分子(zǐ)生物學研究等多種領域。
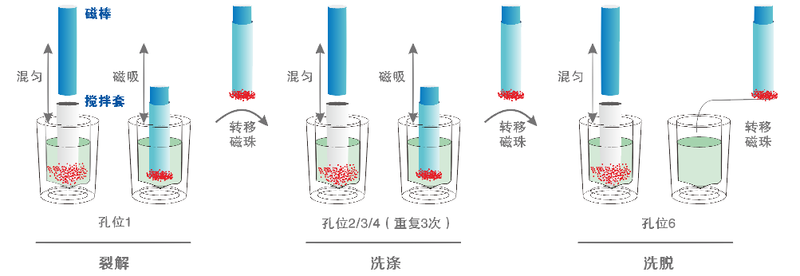
(機器自動化磁珠法圖解)
-
【核酸提取常見問題】核酸提取量過少是(shì)什麽原因導緻的(de)?如何解決?
核酸提取量過少,主要(yào / yāo)原因及解決措施如下:
原因一(yī / yì /yí):實驗材料不(bù)佳或量少。
解決方法:盡量選用新鮮(幼嫩)的(de)材料。
原因二:材料破壁或裂解不(bù)充分。
解決方法:動植物要(yào / yāo)勻漿研磨充分;G+菌、酵母裂解前先用生物酶或機械方式破壁;高溫裂解時(shí),時(shí)間适當延長(對于(yú)動物細胞、細菌可增加PK的(de)用量)。
原因三:沉澱不(bù)完全。
解決方法:(1)低溫沉澱,延長沉澱時(shí)間。(2)加輔助物,促進沉澱。
原因四:洗滌時(shí)DNA丢失。
解決方法:洗滌時(shí),最好用槍頭将洗滌液吸出(chū),勿傾倒。
-
【核酸提取常見問題】DNA降解是(shì)什麽原因導緻的(de)?如何避免?
DNA降解,主要(yào / yāo)原因及解決方法如下:
原因一(yī / yì /yí):材料不(bù)新鮮或反複凍融。
解決方法:盡量取新鮮材料,低溫保存材料避免反複凍融。
原因二:未很好抑制内源核酸酶的(de)活性。
解決方法:(1)液氮研磨或勻漿組織後,應站在(zài)解凍前加入裂解緩沖液。
(2)在(zài)提取内源核酸酶含量豐富的(de)材料的(de)DNA時(shí),可增加裂解液中螯合劑的(de)含量。
原因三:提取過程操作過于(yú)劇烈,DNA被機械打斷。
解決方法:細胞裂解後的(de)後續操作應盡量輕柔。
原因四:被外源核酸酶污染。
解決方法:所有試劑用無菌水配制,耗材經高溫滅菌。
原因五:反複凍融。
解決方法:将DNA分裝保存在(zài)緩沖液中,避免反複凍融。
-
【PCR實驗常見問題】無擴增産物(假陰性)的(de)可能原因及解決方法有哪些?
無擴增産物(假陰性)的(de)可能原因及解決方法一(yī / yì /yí)覽表
序号
可能原因
解決方法
1
模闆含有抑制物或模闆含量低
純化模闆或者使用試劑盒提取模闆DNA或加大(dà)模闆的(de)用量
2
Buffer對樣品不(bù)合适
更換Buffer或調整濃度
3
引物設計不(bù)當或者發生降解
重新設計引物(避免鏈間二聚體和(hé / huò)鏈内二級結構)或者換一(yī / yì /yí)管新引物
4
反應條件:退火溫度太高,延伸時(shí)間太短
降低退火溫度、延長延伸時(shí)間
-
【PCR實驗常見問題】爲(wéi / wèi)何空白對照會出(chū)現目的(de)擴增産物(假陽性)?如何避免?
空白對照出(chū)現目的(de)擴增産物,屬于(yú)出(chū)現了(le/liǎo)靶序列或擴增産物的(de)交叉污染,爲(wéi / wèi)避免這(zhè)種情況發生,應注意以(yǐ)下幾點:
(1)實驗操作時(shí)小心輕柔,防止将靶序列吸入加樣槍内或濺出(chū)離心管外。
(2)除酶及不(bù)能耐高溫的(de)物質外,所有試劑或器材均應高壓消毒。所用離心管及加樣槍頭等均應一(yī / yì /yí)次性使用。
(3)各種試劑最好先進行分裝,然後低溫貯存。
-
【ELISA實驗常見問題】試驗結果白闆,而(ér)且陽性對照不(bù)顯色,可能原因及解決方法有哪些?
試驗結果白闆,而(ér)且陽性對照不(bù)顯色,常見原因以(yǐ)及解決方法如下:
(1)可能原因:漏加或者誤加試劑;
解決方法:檢查試驗記錄和(hé / huò)剩餘試劑。每次加液前均應核對标簽。
(2)可能原因:試劑過期;
解決方法:使用有效期内的(de)産品。
(3)可能原因:洗闆液配制中出(chū)現問題,如量筒不(bù)幹淨含HRP酶抑制物(疊氮鈉等);
解決方法:使用幹淨的(de)器皿,正确配制試劑。
(4)可能原因:溫育的(de)時(shí)間或溫度不(bù)夠;
解決方法:校正溫育箱溫度。
(5)可能原因:标準品失活或者丢失;
解決方法:标準品正确保存、溶解和(hé / huò)混勻。
(6)可能原因:抗體失活或者丢失;
解決方法:更換抗體或者提高抗體濃度。
(7)可能原因:酶失活或者丢失;
檢查方法:把工作濃度的(de)酶再稀釋20-100倍,取5uL加入50ul的(de)顯色底物,終止後顯色是(shì)否能達到(dào)1.0左右,此爲(wéi / wèi)酶的(de)粗略估計。
解決方法:更換酶或者提高酶的(de)濃度。
(8)可能原因:顯色底物失活;
檢查方法:加少量的(de)工作濃度的(de)酶,TMB是(shì)否很快顯色。
解決辦法:更換顯色底物。
-
【ELISA實驗常見問題】實驗結果空白背景高,是(shì)什麽原因造成的(de)?如何解決?
ELISA實驗結果空白背景高,常見原因如下:
(a)可能原因:洗闆不(bù)幹淨;
解決方法:充分洗滌,徹底拍幹;洗闆要(yào / yāo)防止交叉污染;濃縮洗液準确配制;吸嘴盡可能一(yī / yì /yí)次性使用;加樣或加酶拍闆的(de)濾紙應棄去不(bù)用,不(bù)要(yào / yāo)反複使用,否則易造成污染。
(b)可能原因:顯色液變質或者試劑過期;
解決方法:檢查試劑盒有效期。
(c)可能原因:試劑稀釋有誤,如加酶的(de)濃度過高;
解決方法:請按說(shuō)明書所示稀釋倍數配制;
(d)可能原因:蒸餾水受酶等污染;
解決方法:使用新鮮蒸餾水。
(e)可能原因:試劑混用;
解決方法:不(bù)同批号試劑勿混用。
(f)可能原因:培養箱溫度超過37℃或反應時(shí)間過長;
解決方法:顯色反應時(shí)間适當縮短。



